МЕХАНИЗМЫ РЕАЛИЗАЦИИ НЕКОТОРЫХ ФИЗИЧЕСКИХ ЭФФЕКТОВ
В. В. Митрофанов
Ранее нами было высказано предположение о том, что при протекании
некоторых электрохимических процессов выделение водорода
осуществляется
через стадию образования метастабильной возбужденной молекулы, несущей избыток энергии [1]. Эта гипотеза оказалась полезной при объяснении механизмов реализации эффекта Рассела и эффекта Крамера.
 Эффект Рассела (ЭфР) заключается в почернении фотопленки, помещенной над поверхностью металла, свободной от слоя окисла
[2], а эффект Крамера (ЭфК) — в обнаружении свободных электронов с помощью детектора электронов над чистой поверхностью металла [3]. Было высказано немало гипотез, объясняющих эти эффекты, но ни одна не может дать удовлетворительное объяснение этих явлений.
Эффект Рассела (ЭфР) заключается в почернении фотопленки, помещенной над поверхностью металла, свободной от слоя окисла
[2], а эффект Крамера (ЭфК) — в обнаружении свободных электронов с помощью детектора электронов над чистой поверхностью металла [3]. Было высказано немало гипотез, объясняющих эти эффекты, но ни одна не может дать удовлетворительное объяснение этих явлений.
В принципе, запретов на оба эффекта со стороны фундаментальных законов физики нет, более того, хорошо известна химическая реакция, порождающая эти явления — окисление элемента, находящегося в ряду напряжения левее водорода.
Э +Н2О -> ЭО +Н2. (1)
Однако при более внимательном рассмотрении ситуации мы сталкиваемся с физическим противоречием
— электроны, порождаемые металлической поверхностью, имеют столь малую энергию, что их средний пробег в воздухе не превышает долей мм, т.е. они просто не могут достигнуть счетчика излучений для реализации
ЭфК или фотослоя при ЭфР, и тем не менее
излучение фиксируется.
В терминах ТРИЗ ФП может быть
сформулировано следующим образом:
-
энергия электронов, возникающая при окислении поверхности металлов слишком мала для того, чтобы достигнуть детектора;
-
энергия электронов достаточна для того, чтобы детекторы фиксировали наличие электронов.
Разрешить это противоречие можно, предположив,
что поверхность испускает одни электроны, а детектор
фиксирует другие, каким-то образом связанные с первичными, иными словами, в процессе присутствует, по крайней мере,
еще один компонент — посредник, способный переносить
энергию от места ее выделения до места
ее регистрации. Таким посредником не может
быть ни атомарный водород Н, время жизни которого очень мало, ни молекулярный водород Н2, который
энергетически стабилен и ни с фотослоем, ни с детектором электронов не взаимодействует.
Можно предположить, что в процессе окисления по реакции (1) могут
возникать не только молекулы водорода в основном стабильном состоянии, но и возбужденные молекулы, несущие избыток энергии,
Э +Н2О -> ЭО +Н2* (1а)
Согласно квантово-механическим представлениям, судьба возбужденной молекулы может быть различной:
— передача кванта подобной молекуле, так же как передается импульс при упругом
столкновении бильярдных шаров,
Н2*+Н2 ->
Н2 + Н2* (2)
— рассеяние в виде тепла при столкновении со стенкой сосуда другими атомными и молекулярными частицами,
Н2*+А -> Н2 +А
+q (3)
— изменение собственного состояния:
— распад на атомы,
Н2* -> Н +Н (4а)
—
безызлучательная дезактивация,
Н2*+Н2
->
Н2 +2Н++2е- (4б)
Именно электроны, выделяющиеся при реакции
(46), фиксируются при регистрации ЭфК и ЭфР.
Присутствие возбужденных молекул водорода позволило нам объяснить и необычный вид фотографий,
полученных при регистрации ЭфР — наличие чередующихся светлых и темных концентрических колец, напоминающих картину
интерференции волн. Р. Вуд еще в 1922 г. показал, что взаимодействие водорода с зерном йодистого серебра происходит
с выделением тепла [4]:
Н2* +AgBr -> H2 +AgBr +q (5)
AgBr + q -> Ад +Вг. (6)
Можно предположить, что атомарный бром,
выделившийся в реакции (6), с одной стороны, служит ловушкой для энергии возбужденного водорода,
Br +H2* -> HBr +H +q (7a)
Н+Н -> Н2 (7б)
 а с другой
стороны, мигрируя от места выделения в «черном
кольце», взаимодействует с зернами AgBr, понижая
их светочувствительность, что приводит к образованию светлого кольца. Метод регистрации колец
может быть использован для изучения фотохимических
реакций.
а с другой
стороны, мигрируя от места выделения в «черном
кольце», взаимодействует с зернами AgBr, понижая
их светочувствительность, что приводит к образованию светлого кольца. Метод регистрации колец
может быть использован для изучения фотохимических
реакций.
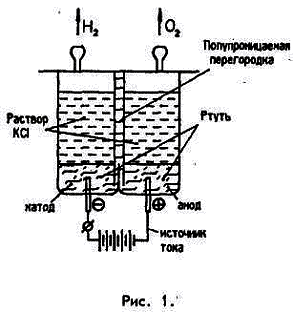
Обратимся к еще одному малопонятному
явлению — перенапряжению водорода на ртутном
катоде,— заключающемуся в том, что электролиз
воды выделением водорода в электрохимической
ячейке с катодом, выполненным из жидкой ртути, начинается при напряжении источника выше расчетного.
Электролиз описывается следующими уравнениями:
2Н2О -> 2Н2 +О2 (8а)
Н+ + е-
на катоде Н (86)
на катоде Н +Н -> Н2 (8в)
О-+ е- на аноде О (8г)
на аноде О +О -> *О2 (8д)
Явление перенапряжения известно для катодов
из самых разных материалов, оно относится к общему
классу явлений поляризации электродов,
и его обычно объясняют перекрытием части
поверхности электрода микропузырьками выделившегося водорода, адсорбируемых поверхностными слоями электрода, причем
эти микропузырьки затрудняют проход носителей
заряда из раствора к электроду. Необычно
в поведении ртутного катода то, что сама
по себе поверхность жидкой ртути менее
всего способна к удержанию микропузырьков водорода, а эффект перенапряжения
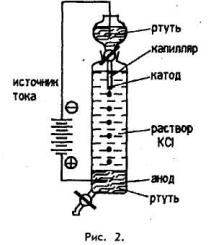
проявляется и при про- ведении электролиза даже в ячейке с капельным катодом (рис.
2), где поверхность ртути все время обновляется.
Для явления перенапряжения водорода на ртутном катоде можно сформулировать следующее ФП:
— перенапряжения на ртутном катоде не должно быть, поскольку не должно быть поляризации жидкой поверхности ртути;
— перенапряжение водорода на ртутном катоде существует.
Для разрешения противоречия предположим, что в результате реакции (8в) наряду с молекулами водорода в
основном состоянии с минимумом энергии
возникают и метастабильные энергонасыщенные возбужденные молекулы водорода Н2*:
Н +Н -> Н2* (9)
Ранее мы показали, что для реализации ЭфК и ЭфР необходимо протекание реакции
(4б) с выделением двух катионов водорода. В
условиях электролиза это означает, что часть молекул водорода, образовавшихся
по «прямым» реакциям (8г - 9), превращается в
исходное состояние катионов водорода и
на их повторную разрядку источник тока
затрачивает дополнительную работу, которую
мы регистрируем как перенапряжение.
Характерно, что величина перенапряжения минимальна для катодов из платины и палладия,
в которых молекулярный водород хорошо растворяется.
Внутри кристаллической решетки легко протекает процесс тепловой диссипации по реакции
(3), что приводит к нагреву катода, фиксируемому
экспериментально.
ЛИТЕРАТУРА
1. Митрофанов
В. В., Соколов В. А. О природе эффекта Рассела, ФТТ т. 16, 1974, с. 2435—2437.
2. Сб. Экзоэлектронная
химия. М., ИЛ, 1962.
3. Rassel Nj. Proc.Roy.Soc.London, 61, 1897, 424.